研究概要Research
現在とりくんでいる研究テーマ
脳・脊髄から構成される中枢神経系は様々な高次機能を制御しており、これらの異常が神経変性疾患や精神疾患、慢性疼痛といった疾患を引き起こすといわれています。中枢神経系はその名が示すように神経細胞が主な構成成分ですが、その他にも様々な細胞が存在しています。その一つがアストロサイトやミクログリアといったグリア細胞です。近年の研究からグリア細胞の機能異常が、多くの中枢神経疾患に関与していることが明らかになってきています。私たちの研究室では、特に慢性疼痛と気分障害、認知機能障害といった病態におけるグリア細胞の役割をさまざまな角度から解析しています。
慢性疼痛に関する研究
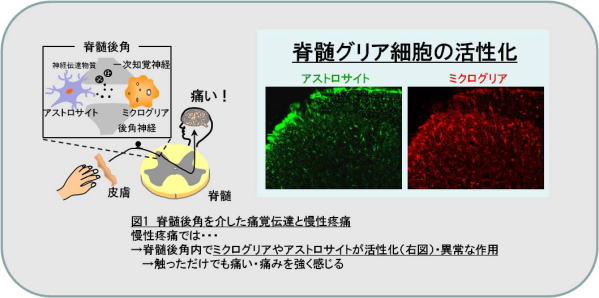
慢性疼痛の有病率は成人人口の22.5%と推定されています。高齢化やストレス社会を背景に有病率は今後も増加することが予想されます。慢性疼痛には慢性的な炎症が原因となる関節リウマチや変形関節症などの炎症性疼痛、末梢神経や中枢神経が直接損傷されることに起因する帯状疱疹後神経痛、糖尿病性疼痛などの神経障害性疼痛、組織のどこにも発痛物質や炎症は存在せず、また神経損傷も認められないにもかかわらず全身に痛みを生じる線維筋痛症や慢性腰痛などの非器質性疼痛が挙げられます。これらの慢性疼痛はモルヒネなどのオピオイドやロキソニン・インドメタシン等の非ステロイド性抗炎症薬(NSAIDs)といった既存の鎮痛薬が奏功しにくいといわれています。それ故、新たな作用メカニズムを有する鎮痛薬の創薬が必要不可欠です。その慢性疼痛治療の新たな標的として注目されているのがグリア細胞(ミクログリア・アストロサイト)です。最近の研究から、脊髄や脳に存在するグリア細胞の機能異常が慢性疼痛の惹起に関与していることが明らかとなっています(図1)。
また慢性疼痛により情動や認知機能にも影響が生じること明らかとなってきました。実際に、慢性疼痛により気分障害や認知症を発症するリスクが高まることが報告されています。持続する痛みが強いストレスとなり、これらの高次機能に変化をもたらし、さらに痛みの受容にも悪影響を与えている可能性が予想されますが、その詳細なメカニズムは明らかではありません。最近の研究から、これらにもグリア細胞が重要な働きをしていることが明らかとなってきています。
私たちの研究室では、脳・脊髄でのグリア細胞の機能をコントロールすることが、新たな鎮痛薬開発のヒントとなるのではないかと考え、研究を行っています。
また慢性疼痛により情動や認知機能にも影響が生じること明らかとなってきました。実際に、慢性疼痛により気分障害や認知症を発症するリスクが高まることが報告されています。持続する痛みが強いストレスとなり、これらの高次機能に変化をもたらし、さらに痛みの受容にも悪影響を与えている可能性が予想されますが、その詳細なメカニズムは明らかではありません。最近の研究から、これらにもグリア細胞が重要な働きをしていることが明らかとなってきています。
私たちの研究室では、脳・脊髄でのグリア細胞の機能をコントロールすることが、新たな鎮痛薬開発のヒントとなるのではないかと考え、研究を行っています。
慢性疼痛におけるHMGB1
.jpg)
High mobility group box-1 (HMGB-1)は細胞核内に存在し、普段は遺伝子複製などに関与するタンパク質です。一方で、細胞に刺激が加わる、または細胞が死滅するなどにより、細胞外に遊離あるいは漏出し、炎症性物質として作用します。最近の研究から様々な炎症性疾患(敗血症、脳卒中、循環器系疾患、糖尿病、関節リウマチ、がんなど)の発症に関係していることが分かってきました。私たちはこのHMGB1と慢性疼痛の関係に着目して研究を行ってきました。その結果、坐骨神経損傷により発症させた神経障害性疼痛モデルにおいて、脊髄後角においてHMGB1量が増加していることを見出しました。またHMGB1に対する中和抗体(HMGB1をトラップする作用)を静脈内から投与しますと、痛みが軽減することが示され、HMGB1が慢性疼痛の重要な因子の一つであることが明らかとなりました(PLoS One, 2013)。
脊髄後角で増加したHMGB1はグリア細胞を活性化することで痛みを惹起することが予想されますが、その詳細なメカニズムは分かっていませんでした。私たちは脊髄後角で増加したHMGB1が主にアストロサイトを活性化し、炎症性サイトカインであるinterleukin-1βを産生・放出することで、痛みの伝達を亢進していることを明らかにしました(J. Neurochem., 2019)。
さらに、神経障害性疼痛モデルマウスにおける傷害坐骨神経でのHMGB1の発現変化と、HMGB1に対する中和抗体を局所投与することによる鎮痛効果を検討したところ、神経障害性疼痛モデルマウスの傷害坐骨神経において、対照群(神経に傷害のないマウス群)と比較してHMGB1発現量が増加することを明らかにしました。またこの増加は、傷害によって集積した炎症性細胞(マクロファージ)に依存していることが分かりました。さらに、傷害坐骨神経の周辺部にHMGB1に対する中和抗体を投与することにより、痛みが有意に緩和されることを発見しました。また傷害坐骨神経の周辺部で増加したHMGB1は、さらに別の痛み誘発物質を増加させることで痛みを慢性化させていることも明らかになりました(2015年12月3日付の日経産業新聞、J. Neurochem., 2016、図2)。また最近の研究から、坐骨神経で増加したHMGB1は知覚神経を刺激することで、脊髄後角への情報伝達を活性化し、同部位に存在するミクログリアを活性化させることで、痛みを惹起させていることも明らかとなってきました。
以上のことから、慢性疼痛時においてHMGB1は脊髄後角ならびに傷害坐骨神経にて増加していることが分かりました。さらにHMGB1は脊髄後角ではアストロサイトを、傷害坐骨神経ではマクロファージやミクログリアをそれぞれ介して、痛みの慢性化を引き起こしていることが明らかとなりました。
これらに加えて、最近は三叉神経ニューロパチーやパーキンソン病に伴う痛みに対するHMGB1の関わりや、慢性疼痛時の情動変化や認知機能低下に対するHMGB1の関与についても研究を展開しています。
脊髄後角で増加したHMGB1はグリア細胞を活性化することで痛みを惹起することが予想されますが、その詳細なメカニズムは分かっていませんでした。私たちは脊髄後角で増加したHMGB1が主にアストロサイトを活性化し、炎症性サイトカインであるinterleukin-1βを産生・放出することで、痛みの伝達を亢進していることを明らかにしました(J. Neurochem., 2019)。
さらに、神経障害性疼痛モデルマウスにおける傷害坐骨神経でのHMGB1の発現変化と、HMGB1に対する中和抗体を局所投与することによる鎮痛効果を検討したところ、神経障害性疼痛モデルマウスの傷害坐骨神経において、対照群(神経に傷害のないマウス群)と比較してHMGB1発現量が増加することを明らかにしました。またこの増加は、傷害によって集積した炎症性細胞(マクロファージ)に依存していることが分かりました。さらに、傷害坐骨神経の周辺部にHMGB1に対する中和抗体を投与することにより、痛みが有意に緩和されることを発見しました。また傷害坐骨神経の周辺部で増加したHMGB1は、さらに別の痛み誘発物質を増加させることで痛みを慢性化させていることも明らかになりました(2015年12月3日付の日経産業新聞、J. Neurochem., 2016、図2)。また最近の研究から、坐骨神経で増加したHMGB1は知覚神経を刺激することで、脊髄後角への情報伝達を活性化し、同部位に存在するミクログリアを活性化させることで、痛みを惹起させていることも明らかとなってきました。
以上のことから、慢性疼痛時においてHMGB1は脊髄後角ならびに傷害坐骨神経にて増加していることが分かりました。さらにHMGB1は脊髄後角ではアストロサイトを、傷害坐骨神経ではマクロファージやミクログリアをそれぞれ介して、痛みの慢性化を引き起こしていることが明らかとなりました。
これらに加えて、最近は三叉神経ニューロパチーやパーキンソン病に伴う痛みに対するHMGB1の関わりや、慢性疼痛時の情動変化や認知機能低下に対するHMGB1の関与についても研究を展開しています。
慢性疼痛における核内受容体REV-ERBs
.jpg)
時計遺伝子である一つであるREV-ERBsがC6グリオーマ細胞(アストロサイト細胞株)における炎症性物質産生の制御に関与していることを明らかにした(Biochem. Biophys. Res. Commun., 2016)ことから、REV-ERBs活性を制御する薬物が新たな鎮痛薬となる可能性に着目しました。その結果、実験的に活性化させたアストロサイトからの痛み誘発物質の産生が、REV-ERBs刺激薬により抑制されることを明らかにしました。また坐骨神経痛、炎症性疼痛、糖尿病性疼痛、抗がん薬誘発性疼痛を誘発したそれぞれのモデルマウスに対して、REV-ERBs刺激薬を投与すると痛みが緩和されました。さらに、この鎮痛効果は、脊髄アストロサイトを抑制することで、それらからの痛み誘発物質の産生を抑制することに起因することを発見しました(2019年2月21日付の日刊工業新聞、Brain, Behav., and Immun., 2019、図3)。また最近、REV-ERBsによりミクログリア活性も抑制されることが明らかとなり、この作用もREV-ERBs刺激薬による鎮痛効果に関わっている可能性が予想されます。
従来、単一の痛み誘発物質を標的とする薬剤が鎮痛薬として注目されてきましたが、痛みシグナルの促進には様々な物質が関与するため、その効果は限定的でした。一方で、REV-ERBs刺激薬は、“痛みシグナル促進の元凶”となっているアストロサイトやミクログリアを抑制し、さらにそれらから産生される複数の痛み誘発物質を減少させるため、鎮痛薬として有効性が高く、応用性にも優れている可能性があります。
従来、単一の痛み誘発物質を標的とする薬剤が鎮痛薬として注目されてきましたが、痛みシグナルの促進には様々な物質が関与するため、その効果は限定的でした。一方で、REV-ERBs刺激薬は、“痛みシグナル促進の元凶”となっているアストロサイトやミクログリアを抑制し、さらにそれらから産生される複数の痛み誘発物質を減少させるため、鎮痛薬として有効性が高く、応用性にも優れている可能性があります。
慢性疼痛における気分障害・認知機能障害
痛みが情動面におよぼす影響に関しては、未だ不明瞭な点が多いのが現状です。痛みによる不快情動は、生体警告系の役割を担う面では重要ですが、持続的な痛みに起因する不快情動は、QOL低下のみならず、精神疾患発症の引き金にもなることが知られています。実際に、慢性疼痛患者において、うつ病・不安症などの気分障害や認知機能障害が発症する割合が高いことが報告されています。一方で、精神疾患が痛みを増悪させることも知られていることから、悪循環が生じて疼痛が慢性化・複雑化していると考えられています。したがって、痛みの感覚面だけでなく情動面にも考慮した慢性疼痛治療の必要性、さらには、その基盤となる基礎的知見の集積が求められています。我々は、行動薬理学的手法や免疫組織化学的手法といった様々な実験技術を用いて、脳における炎症免疫機構に関わるグリア細胞(アストロサイト、ミクログリア)の役割に着目しつつ、慢性疼痛とうつ病に共通する病態基盤を明らかにし、新たな治療薬創製に向けた研究を行っています。最近の研究成果から、神経障害性疼痛モデル動物において、坐骨神経障害後2週間(急性期)ではなく、坐骨神経障害後8週間(慢性期)で、不安・うつ様行動などが生じることを明らかにしました。また、そのメカニズムとして前帯状皮質におけるHMGB1増加に伴うミクログリアの活性化が関与することを明らかにしました(Prog Neuropsychopharmacol Biol Psychiatry., 2019)。
また、慢性疼痛や気分障害の治療に用いられる抗うつ薬のグリア細胞における薬理作用についても研究を行っています(Eur J Pharmacol., 2019)。
また、慢性疼痛や気分障害の治療に用いられる抗うつ薬のグリア細胞における薬理作用についても研究を行っています(Eur J Pharmacol., 2019)。